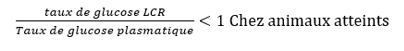= Méningo-encéphalite thrombosante infectieuse, complexe H. somnus, hémophilose bovine, histophilose, « sleeper syndrome »
Etiologie : Histophilus somni, aussi connu sous le nom de Haemophilus somnus. Bactérie gram négatif non sporulée (1). Elle peut être à l’origine de broncho-pneumonies suppurées avec de sévères lésions des lobes cranio-ventraux, et peut être impliquée dans des cas de fièvre des transport ou de pasteurellose (2).
Epidémiologie : Répartition mondiale. Taux d’infection élevé, mais peu de cas cliniques. Sporadique (3). Souvent plusieurs animaux sont touchés en une période de quelques semaines à quelques mois (4). Touche plus fréquemment les animaux à l’engraissement âgés de plus de 4 mois (4). Expressions cliniques très variées (formes respiratoires « complexe respiratoire bovin », formes articulaires, peut toucher la mamelle, l’appareil uro-génital, l’appareil cardiaque ou provoquer des avortements ou des formes nerveuses), la forme nerveuse ayant une mortalité élevée (1).
Pathogénie : Prolifération locale au niveau d’une muqueuse (génitale, respiratoire…) jusqu’à provoquer une bactériémie. En interagissant avec les cellules de l’endothélium vasculaire, les bactéries provoquent une exposition du collagène et la cascade de la coagulation s’initie. Une thrombose se met en place, notamment au niveau de l’encéphale, du cœur et des poumons.
Signes cliniques évocateurs : Mort subite possible. Signes neurologiques sévères avec souvent un abattement très marqué, un animal en décubitus latéral pouvant présenter un opisthotonos et des convulsions, avec des paupières fermées ou entrouvertes (donnant le « regard somnolent » à l’origine du nom « sleeper syndrome ») (1) et une sialorrhée (2). L’animal peut présenter une cécité (3) d’un ou des deux yeux, avec des hémorragies rétiniennes ainsi que des foyers de nécrose et d’œdème de la rétine qui apparaissent en début d’évolution (2), ainsi qu’une hyperthermie très marquée fréquente et souvent précoce (2) (peut être supérieure à 42°C, mais disparait souvent en quelques heures (3)). Une ataxie et une faiblesse sont également observées. Un coma en phase terminale est possible, avec une mort survenant en quelques heures à quelques jours. Selon la région du système nerveux affecté, d’autres signes cliniques sont possibles mais inconstants : marche en cercle, nystagmus et hyperexcitabilité (3).
Autres signes cliniques: des troubles respiratoires peuvent être observés une à 2 semaines environ avant l’apparition des signes neurologiques.
Diagnostic différentiel :
- Méningite (H. somni peut causer des méningites simples) (4)
- Listériose (différence via analyse du LCR : protéines élevées dans les 2 cas, mais le taux de cellules nucléées est très élevé en cas d’infection par H. somni et est surtout composé de polynucléaires neutrophiles)
- Nécrose du cortex cérébral
- Hypovitaminose A
- Intoxication aiguë au plomb
- Pasteurellose
- Rage
Diagnostic expérimental : Le diagnostic de certitude est souvent post-mortem, l’évolution étant très rapide. Dans les cas sévères aigus et fatals, la numération formule présente des changements brutaux : neutropénie et leucopénie. Dans les cas moins graves, une neutrophilie est observée. Lorsque des isolats sont réalisés, ceux obtenus au niveau de l’appareil génital (vagin ou prépuce) sont différents de ceux obtenus sur échantillon sanguin d’animaux septicémiques (1). A l’autopsie, des infarctus hémorragiques sont souvent visibles au niveau de l’encéphale et de la moelle épinière. Lésions histologiques : thrombose de petits vaisseaux associée à une nécrose des tissus qui fait suite à une infiltration de polynucléaires neutrophiles contenant les bactéries. La mesure du taux d’anticorps sérique (suite à une infection expérimentale) n’est pas corrélée à l’infection, l’immunité humorale ne permet donc pas de protéger l’animal de la maladie (1). Le LCR apparait souvent décoloré (2). La mise en culture de H. somni nécessite un milieu enrichi et une atmosphère microaérophile, et il n’est pas différenciable de H. ovis et H. agni (agents de septicémies, mammites et épididymites ovines) (3).
Pronostic : Développement rapide des signes cliniques avec souvent mort en moins de 36h (1). Si les animaux sont capables de se tenir debout et reçoivent un traitement précoce, le pronostic est meilleur.
Traitement : à réaliser seulement si l’animal est dans un stade précoce de la maladie. Le traitement des animaux en décubitus ou avec une atteinte neurologique sévère ne donne pas de résultats (1). Si l’on décide de traiter, il faut isoler l’animal (2,3), et on peut utiliser plusieurs antibiotiques (les infarctus et les lésions des endothéliums vasculaires permettant un passage à travers la barrière hémato-méningée). On peut utiliser des tétracyclines (oxytétracycline à 10 mg/kg IV 2 fois par jour pendant plus de 3 jours ou jusqu’à amélioration de l’état clinique ; oxytétracycline longue action à 20 mg/kg IM 1 fois tous les 2 jours avec 3 injections au maximum) avec un relais à base de pénicilline G procaïne à 20 000 UI/kg en IM jusqu’à guérison totale (ces antibiotiques présentent normalement une mauvaise concentration dans le LCR, mais l’inflammation permet un passage facilité de la barrière hémato-méningée (3)). L’usage de streptomycine ou de florfénicol est aussi possible (3). Des AINS peuvent aider à lutter contre l’hyperthermie, l’inflammation et la douleur (1).
Prévention : Si suspicion ou confirmation d’un cas dans l’élevage, surveillance importante des animaux ayant été en contact (surveillance toutes les 6 à 8h pendant au moins une semaine pour une détection précoce des cas). Un vaccin existant aux USA ne donne pas de résultats intéressant sur le terrain malgré de bons résultats dans le modèle expérimental (1). Le traitement aux oxytétracyclines à l’arrivée en engraissement n’a pas permis de réduire la mortalité mais a diminué l’incidence des formes respiratoires (2).
Sources :
- Francoz D, Couture Y. Manuel de médecine des bovins. Med’com. 2014. 704 p.
- Blowey RW, Weaver AD. Guide pratique de médecine bovine. MED’COM. 2006. 229 p.
- Millemann Y, Fontaine J-J, Arcangioli M-A, Douart A, Maillard R. Les principales affections bactériennes du système nerveux central des bovins. Bull GTV Hors-sér Neuropathol Rumin 2003. 2003;41‑6.
- Peek SF, Divers TJ. REBHUN’S DISEASES OF DAIRY CATTLE, THIRD EDITION. Elsevier; 2018. 849 p.